KOLOID
A. Komponen Sistem Koloid
Koloid
adalah suatu campuran zat heterogen (dua fase) antara dua zat atau lebih di
mana partikel-partikel zat yang berukuran koloid (fase terdispersi/yang
dipecah) tersebar secara merata di dalam zat lain (medium pendispersi/
pemecah). Ukuran partikel koloid berkisar antara 1-100 nm. Jadi, koloid tergolong campuran heterogen dan
merupakan sistem dua fasa.
Jadi, sistem
koloid tersusun atas dua komponen, yaitu fasa terdispersi dan medium dispersi
atau fasa pendispersi.
- Fasa terdispersi bersifat diskontinu (terputus-putus)
- Medium dispersi
bersifat kontinu.
B. Pengelompokan Sistem Koloid
Fase
Terdispersi
|
Fase
Pendispersi
|
Sistem
Koloid
|
Contoh
|
Gas
|
Cair
|
Buih/busa
|
Busa
sabun
|
Gas
|
Padat
|
Busa
padat
|
Batu
apung, lava
|
Cair
|
Gas
|
Aerosol
|
Kabut,
awan, obat semprot
|
Cair
|
Cair
|
Emulsi
|
Susu,
minyak ikan, saos
|
Cair
|
Padat
|
Gel(emulsi
padat)
|
Keju,
mentega, selai, agar-agar, semir padat, mutiara
|
Padat
|
Gas
|
Aerosol
padat
|
Asap,
debu, buangan knalpot
|
Padat
|
Cair
|
Sol
|
Kanji,
cat lem, tinta, lateks, putih telur
|
Padat
|
Padat
|
Sol
padat
|
Perunggu,
kuningan, kaca bewarna, permata(gem)
|
C. Sifat-Sifat Koloid
1. Efek Tyndall
Efek
tyndall ini ditemukan oleh John Tyndall (1820-1893), seorang ahli fisika Inggris.
Oleh karena itu sifat itu disebut efek tyndall.
Efek
tyndall adalah efek yang terjadi jika suatu larutan terkena sinar. Pada saat
larutan sejati disinari dengan cahaya, maka larutan tersebut tidak akan
menghamburkan cahaya, sedangkan pada sistem koloid cahaya akan dihamburkan. Hal itu terjadi karena partikel-partikel koloid mempunyai
partikel-partikel yang relatif besar untuk dapat menghamburkan sinar tersebut.
Sebaliknya, pada larutan sejati, partikel-partikelnya relatif kecil sehingga
hamburan yang terjadi hanya sedikit dan sangat sulit diamati.
2. Gerak Brown
Jika kita
amati system koloid dibawah mikroskop ultra, maka kita akan melihat bahwa
partikel-partikel tersebut akan bergerak membentuk zigzag. Pergerakan zigzag
ini dinamakan gerak Brown. Pergerakan tersebut dijelaskan pada penjelasan
berikut:
Partikel-partikel
suatu zat senantiasa bergerak. Gerakan tersebut dapat bersifat acak seperti
pada zat cair dan gas, atau hanya bervibrasi di tempat seperti pada zat padat.
Untuk system koloid dengan medium pendispersi zat cair atau gas, pergerakan
partikel-partikel akan menghasilkan tumbukan dengan partikel-partikel koloid
itu sendiri. Tumbukan tersebut berlangsung dari segala arah. Oleh karena ukuran
partikel cukup kecil, maka tumbukan yang terjadi cenderung tidak seimbang.
Sehingga terdapat suatu resultan tumbukan yang menyebabkan perubahan arah gerak
partikel sehingga terjadi gerak zigzag atau gerak Brown.
Semakin
kecil ukuran partikel koloid, semakin cepat gerak Brown terjadi. Demikian pula,
semakin besar ukuran partikel kolopid, semakin lambat gerak Brown yang terjadi.
Hal ini menjelaskan mengapa gerak Brown sulit diamati dalam larutan dan tidak
ditemukan dalam zat padat (suspensi).
Gerak
Brown juga dipengaruhi oleh suhu. Semakin tinggi suhu system koloid, maka
semakin besar energi kinetic yang dimiliki partikel-partikel medium
pendispersinya. Akibatnya, gerak Brown dari partikel-partikel fase
terdispersinya semakin cepat. Demikian pula sebaliknya, semakin rendah suhu
system koloid, maka gerak Brown semakin lambat.
3. Elektropresus
Elektroforesis
adalah teknik pemisahan komponen atau molekul bermuatan berdasarkan perbedaan
tingkat migrasinya dalam sebuah medan listrik. Medan listrik dialirkan pada
suatu medium yang mengandung sampel yang akan dipisahkan. Teknik ini dapat
digunakan dengan memanfaatkan muatan listrik yang ada pada makromolekul,
misalnya DNA yang bermuatan negatif. Jika molekul yang bermuatan negatif
dilewatkan melalui suatu medium, kemudian dialiri arus listrik dari suatu kutub
ke kutub yang berlawanan muatannya maka molekul tersebut akan bergerak dari kutub
negatif ke kutub positif. Kecepatan
gerak molekul tersebut tergantung pada nisbah muatan terhadap massanya serta
tergantung pula pada bentuk molekulnya. Pergerakan ini dapat dijelaskan dengan gaya
Lorentz, yang terkait dengan sifat-sifat dasar elektris bahan yang diamati dan
kondisi elektris lingkungan.
Secara
umum, elektroforesis digunakan untuk memisahkan, mengidentifikasi, dan
memurnikan fragmen DNA.
4.
Adsorpsi
Apabila partikel-partikel sol padat ditempatkan dalam zat cair atau gas,
maka pertikel-partikel zat cair atau gas tersebut akan terakumulasi pada
permukaan zat padat tersebut. Fenomena ini disebut adsorpsi. Beda halnya dengan
absorpsi. Absorpsi adalah fenomena menyerap semua partikel ke dalam sol padat
bukan di atas permukaannya, melainkan di dalam sol padat tersebut.
Partikel koloid sol memiliki kemampuan untuk mengadsorpsi
partikel-partikel pada permukaannya, baik partikel netral atau bermuatan
(kation atau anion) karena mempunyai permukaan yang sangat luas.
Contoh
adsorpsi:
-Penyembuhan
diare dengan norit
-Penjernihan
air dengan tawas
-Pencelupan
serat wol untuk proses pewarnaan
-Penjernihan
air tebu pada pembuatan gula
-Penyerapan
humus oleh tanah liat
5. Koagulasi
Koagulasi merupakan salah satu sifat dari koloid. Partikel-partikel
suatu koloid dapat mengalami penggumpalan membentuk zat semi-padat.
Partikel-partikel koloid tersebut bersifat stabil karena memiliki muatan
listrik sejenis. Apabila muatan listrik itu hilang, maka partikel koloid
tersebut akan bergabung membentuk gumpalan. Proses penggumpalan partikel koloid
dan pengendapannya disebut Koagulasi. Dalam hal ini, koagulasi koloid merupakan
proses bergabungnya partikel-partikel koloid secara bersama membentuk zat
dengan massa
yang lebih besar.
Contoh
koagulasi:
-Pembentukan
delta di muara sungai terjadi karena koloid tanah liat dalam air sungai
mengalamikoagulasi ketika bercampur dengan elektrolit dalam air laut.
-Pada
pengolahan karet, partikel-partikel karet dalam lateks digumpalkan dengan
penambahan asam asetat atau asam format sehingga karet dapat dipisahkan dari
lateksnya.
-Lumpur
koloidal dalam air sungai dapat digumpalkan dengan menambahkan tawas. Sol tanah
liatdalam air sungai biasanya bermuatan negatif sehingga akan digumpalkan oleh
ion Al 3+ dari tawas (alumunium sulfat)
-Jika
bagian tubuh mengalami luka maka ion Al 3+ atau Fe 3+ segera nenetralkan
partikelalbuminoid yang dikandung darah sehingga terjadi penggumpalan darah
yang menutupi luka.
6. Koloid Pelindung
Sistem koloid di mana partikel terdispersinya mempunyai daya adsorpsi
relatif besar disebut koloid liofil yang bersifat lebih stabil. Sedangkan jika
partikel terdispersinya mempunyai gaya
absorpsi yang cukup kecil, maka disebut koloid liofob yang bersifat kurang
stabil. Yang berfungsi sebagai koloid pelindung ialah koloid liofil.
Contoh
koloid pelindung:
-Pada
pembuatan es krim digunakan gelatin untuk mencegah pembentukan Kristal besar
atau gula
-Cat
dan tinta dapat bertahan lama karena menggunakan suatu koloid pelindung.
-Zat-zat
pengemulsi seperti sabun dan detergen juga tergolong koloid pelindung.
7. Dialisis
Dialisis merupakan salah satu sifat dari sistem koloid. Dialisis adalah
suatu proses permunian partikel koloid dari ion-ion penganggu kestabilan koloid
dengan penyaringan mengunakan membran atau selaput semipermeabel. Selaput
semipermeabel adalah sejenis alat saring yang dibuat khusus untuk keperluan
dialisis koloid yang memiliki daya saring sangat tinggi. Selaput semipermeabel
ini hanya melewatkan molekul air dan ion-ion saja, sedangkan partikel koloid
tetap tinggal.
Prinsip dialisis atau pemisahan koloid dari ion-ion penganggu ini
didasarkan pada perbedaan laju transport partikel. Proses Dialisis Koloid
sangatlah sederhana. Koloid yang akan di dialisis dimasukan kedalam sebuah
kantong yang terbuat dari selaput semipermeabel. Jika kantong berisi koloid
tersebut kemudian dimasukan kedalam sebuah tempat berisi air yang mengalir,
maka ion-ion penganggu akan menembus selaput semipermeabel bersama air dan yang
tinggal selaput semipermeabel hanyalah koloid yang telah dimurnikan.
D. Pembuatan Sistem Koloid
Bagaimana sistem koloid dibuat? Sistem koloid dapat dibuat dengan dua
metode, yaitu dengan metode mengelompokkan (agregasi) partikel larutan
sejati dan atau menghaluskan bahan kasar kemudian mendispersikan ke
dalam medium pendispersi. Metode pertama disebut kondensasi dan yang
kedua disebut dispersi.
1. Pembuatan Koloid dengan Metode Dispersi
Beberapa metode praktis yang biasa digunakan untuk membuat koloid yang
tergolong cara dispersi adalah cara mekanik, cara peptisasi,
homogenisasi, dan cara busur listrik redig.
a. Pembuatan Koloid dengan Cara Mekanik
Zat-zat yang berukuran besar dapat direduksi menjadi partikel berukuran
koloid melalui penggilingan, pengadukan, penumbukan, dan penggerusan.
Zat-zat yang sudah berukuran koloid selanjutnya didispersikan ke dalam
medium pendispersi.
Cara mekanik, contohnya:
-Pengilingan kacang kedelai pada pembuatan tahu dan kecap. Pembuatan cat
di industri, caranya bahan cat digiling kemudian didispersikan ke dalam
medium pendispersi, seperti air.
-Teknik penumbukan dan pengadukan banyak digunakan dalam pembuatan
makanan, seperti kue tart dan mayones. Kuning telur, margarin, dan gula
pasir yang sudah dihaluskan, kemudian dicampurkan dan diaduk menjadi
koloid.
-Industri makanan, yaitu pada pembuatan es krim, jus buah, selai dan
lainnya. Industri kimia, yaitu pada pembuatan cat, zat pewarna, pasta
gigi, dan detergen.
b. Pembuatan Koloid dengan Busur Listrik Bredig
Arus listrik bertegangan tinggi dialirkan melalui dua buah elektrode
logam (bahan terdispersi). Kemudian, kedua elektrode itu dicelupkan ke
dalam air hingga kedua ujung elektrode itu hampir bersentuhan agar
terjadi loncatan bunga api listrik. Loncatan bunga api listrik
mengakibatkan bahan elektrode teruapkan membentuk atom-atomnya dan larut
di dalam medium pendispersi membentuk sol. Logam-logam yang dapat
membentuk sol dengan cara ini adalah platina, emas, dan perak.
c. Pembuatan Koloid dengan Cara Peptisasi
Dispersi koloid dapat juga diperoleh dari suspensi kasar dengan cara
memecah partikel-partikel suspensi secara kimia. Kemudian, menambahkan
ion-ion sejenis yang dapat diadsorpsi oleh partikel-partikel koloid
sampai koloid menjadi stabil. Koagulasi agregat-agregat yang telah
membentuk partikel-partikel berukuran koloid dapat dihambat karena
adanya ion-ion yang teradsorpsi pada permukaan partikel koloid.
Contohnya, tanah lempung pecah menjadi partikel-partikel berukuran
koloid jika ditambah NaOH dan akan menjadi koloid jika didispersikan ke
dalam air. Partikel-partikel silikat dari tanah lempung akan
mengadsorpsi ion-ion OH– dan terbentuk koloid bermuatan negatif yang
stabil. Cara ini biasa digunakan pada
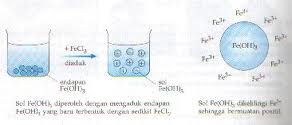
1.sol Al(OH)3 dibuat dengan cara menambahkan HCl encer (sedikit) pada endapan Al(OH)3 yang baru dibuat,
2.sol Fe(OH)3 dibuat dengan cara menambahkan FeCl3 pada endapan Fe(OH)3,
3.sol NiS dapat dibuat dengan cara menambahkan H2S pada endapan NiS.
d. Pembuatan Koloid dengan Cara Homogenisasi
Pembuatan koloid jenis emulsi dapat dilakukan dengan menggunakan mesin penghomogen sampai berukuran koloid.
2. Pembuatan Koloid dengan Metode Kondensasi
Ion-ion atau molekul yang berukuran sangat kecil (berukuran larutan
sejati) diperbesar menjadi partikel-partikel berukuran koloid. Dengan
kata lain, larutan sejati diubah menjadi dispersi koloid. Pembentukan
kabut dan awan di udara merupakan contoh pembentukan aerosol cair
melalui kondensasi molekul-molekul air membentuk kerumunan (cluster).
Proses kondensasi ini didasarkan atas reaksi kimia; yaitu melalui reaksi
redoks, reaksi hidrolisis, dekomposisi rangkap, dan pergantian pelarut.
1. Reaksi Redoks
Contoh:
a. Pembuatan sol belerang dari reaksi redoks antara gas H2S dengan larutan SO2 .
Persamaan reaksinya:
2H2S(g) + SO2(aq) →2H2O(l) + 3S(s)
sol belerang
b. Pembuatan sol emas dari larutan AuCl3 dengan larutan encer formalin (HCHO).
Persamaan reaksinya:
2AuCl3(aq) + 3HCHO(aq) + 3H2O(l) → 2Au(s) + 6HCl(aq) + 3HCOOH(aq)
sol emas
2. Reaksi Hidrolisis
Contoh: pembuatan sol Fe(OH)3 dengan penguraian garam FeCl3 Persamaan reaksinya adalah: mengunakan air mendidih.
FeCl3(aq) + 3H2O(l) → Fe(OH)3(s) + 3HCl( aq)
sol Fe(OH)3
3. Reaksi Dekomposisi Rangkap
Contoh:
a. Pembuatan sol As2S3, dibuat dengan mengalirkan gas H2S dan asam arsenit (H3AsO3) yang encer.
Persamaan reaksinya:
2H3AsO3(aq) + 3H2S(g) → As2S3(s) + 6H2O(l)
sol As2S3
b. Pembuatan sol AgCl dari larutan AgNO3 dengan larutan NaCl encer.
Persamaan reaksinya:
AgNO3(aq) + NaC1(aq) → AgCl(s) + NaNO3(aq)
Sol AgCl
4. Reaksi Pergantian Pelarut
Contoh, pembuatan sol belerang dari larutan belerang dalam alkohol ditambah dengan air. Persamaan reaksinya:
S(aq) + alkohol + air → S(s)
larutan S