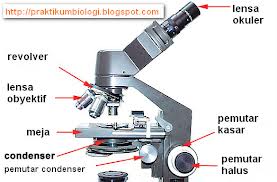
Bagian-Bagian Mikroskop
A.Lensa Okuler
Lensa Okuler adalah lensa yang berfungsi untuk melihat benda sehingga benda tampak lebih besar.
B.Tabung Mikroskop
Tabung mikroskop berfungsi untuk mengatur fokus.tabung ini dapat di turunkan dan dapat di naikkan.
C.Revolver
Revolver letaknya menempel di tabung mikroskop.revolver dapat di putar untuk memilih lensa objektif yang akan digunakan.
D.Tombol pengatur kasar(Makrometer)
Tombol pengatur kasar berfungsi untuk memfokuskan bayangan benda,dapat diputar untuk menaikkan dan menurunkan tabung mikroskop,
E.Tombol pengatur halus(Mikrometer)
Tombol
pengatur halus merupakan tombol yang berfungsi untuk memfokuskan
bayangan benda,sehingga bayangan benda lebih jelas terlihat.
F.Lensa Objektif
Lensa
Objektif berfungsi untuk membentuk bayangan benda dan memperbesar benda
yang akan diamati.pada umumnya,mikroskop mempunyai 3 jenis lensa
objektif dengan perbesaran yang berbeda,yaitu 4x,10x,dan 40x.
G.Lensa Mikroskop
Lengan mikroskop berfungsi sebagai pegangan pada saat mikroskop akan dipindahkan atau diangkat.
H.Meja mikroskop atau meja sediaan
Meja mikroskop berfungsi untuk menyimpan objek yang akan diamati.
I.Penjepit Objek
Agar sediaan tidak bergerak dan kedudukannya stabil pada saat pengamatan,objek di jepit menggunakan penjepit objek.
J.Kondensator
Kondensator
ialah alat yang berfungsi unutuk mengatur intensitas cahaya yang masuk
kedalam mikroskop.tidak semua mikroskop mempunyai kondensor.
K.Diafragma
Diafragma
adalah bagian berupa lubang yang dapat diatur besar kecilnya.fungsi
dari diafragma adalah mengatur banyak sedikitnya cahaya yang masuk
mkedalam mikroskop,.
L.Cermin
Cermin
berfungsi untuk mengarahkan cahaya agar dapat masuk kedalam
mikroskop.cermin ini dapat diputar kesegala arah dan mempunyai dua
permukaan ,yaitu datar dan cekung yang masing-masing mempunyai fungsi
berbeda.
M.Kaki Mikroskop
Kaki
mikroskop merupakan bagian paling bawah dari mikroskop.bagian ini
berfungsi untuk menjaga agar mikroskop tetap berdiri diatas meja.
Bagaimanakah
cara menggunakan mikroskop dengan benar? Untuk dapat menggunakan mikroskop
dengan benar perhatikan langkah-langkah sebagai berikut:
- Menemukan lapang pandang dengan mengatur penyinaran. Untuk menghasilkan lapang
pandang adalah dengan mengatur cermin sambil melihat lensa okuler agar sinar
masuk ke diafragma, sehingga menghasilkan pemantulan yang optimal. Bagian yang terang
berbentuk bulat dinamakan lapang pandang.
- Mengatur fokus mikroskop atau bayangan dengan perbesaran lemah. Letakkan
preparat di atas meja preparat, dijepit dengan penjepit sambil mengamati
mikroskop dari samping tabung mikroskop diturunkan dengan pemutar kasar,
lakukan secara hati-hati hingga lensa objektif tidak menyentuh preparat.
Kemudian lihatlah melalui lensa okuler dan dengan perlahan-lahan naikkanlah
tabung mikroskop sehingga objek terlihat jelas. Setelah objek tampak, putarlah
pemutar halus ke depan atau ke belakang sehingga mendapatkan bayangan
sebaik-baiknya. Perbesaran mikroskop diperoleh dengan cara mengalikan angka
pada lensa objektif dengan angka yang tertera pada lensa okuler. Misalnya 5x
lensa objektif 10x lensa okuler maka perbesarannya 50x.
- Mengatur fokus mikroskop (bayangan dengan perbesaran kuat). Untuk memperoleh
bayangan, dapat dilakukan dengan mengubah lensa objektif yang memiliki
perbesaran lemah dengan yang lebih kuat. Misalnya lensa objektif perbesaran 5x
dapat diganti dengan 10x atau 40x dengan memutar revolver sampai terdengar
suara terdetak. Pemutar halus diputar ke depan atau ke belakang agar diperoleh
objek yang lebih jelas.
- Mengatur Mikroskop dengan posisi disimpan. Setelah mikroskop selesai digunakan,
aturlah mikroskop dengan posisi siap disimpan dengan cara sebagai berikut :
- Tabung mikroskop dinaikkan.
- Preparat diambil.
- Lensa objektif terlemah diturunkan serendah-rendahnya diputar persis sampai
lubang meja mikroskop.
- Diafragma ditutup kembali.
- Kondensor diturunkan dan cermin dalam posisi tegak.
- Angkat mikroskop dengan hati-hati tangan kanan memegang lengan mikrokop dan
topang kaki mikroskop dengan tangan kiri kemudian masukkan ke tempatnya dan
dikunci.
- Membuat preparat tanpa penyayatan. Untuk membuat preparat basah tanpa
penyayatan, misalnya pada waktu pengamatan mikroorganisme yang ada dalam air. Caranya:
air yang akan diamati, diambil dengan pipet tetes dan tempatkan pada kaca
obyektif dan tutup dengan kaca penutup, amati dengan mikroskop.
- Membuat
preparat dengan penyayatan. Membuat preparat pada organ tubuh organisme,
misalnya penampang daun, batang, akar, otot dan lain-lain. Caranya: menyayat
organ setipis mungkin, untuk membuat sayatan yang baik dan tipis dengan alat
yang disebut mikrotom, tetapi bila tidak mempunyai mikrotom dapat dengan menggunakan
silet yang tajam.